| No. | SOAL | PEMBAHASAN |
| 1. |
Kerangka Tabel Periodik Unsur berikut ini digunakan untuk menjawab soal nomor 1 sampai dengan 3.
Nomor atom dari unsur R adalah……
A. 13
B. 14
C. 15
D. 16
E. 20
|
Berdasarkan tabel SPU, unsur R berada pada gol IIA/periode 4, maka nomor atomnya adalah 20. (konfigurasi elektron
R (2,8,8,2)
|
| 2. |
Konfigurasi elektron dari unsur T adalah…..
A. [Ne] 3s23p1
B. [Ne] 3s23p5
C. [Ar] 4s2
D. [Ar] 3d10 4s2
E. [Ar]3d 10 4s24p5 |
Berdasarkan tabel SPU, unsur T berada pada gol VIIA/periode 4, maka nomor atomnya adalah 35. (konfigurasi R (2,8,18,7)
|
| 3. |
Rumus kimia dan jenis ikatan yang terjadi antara X dan Q adalah ...
A. XQ ionik
B. XQ kovalen
C. X2Q ionik
D. XQ2 ionik
E. X2Q kovalen
|
Berdasarkan tabel SPU, unsur X berada pada gol IA cenderung membentuk ion X+, Q golongan VIA cenderung membentuk ion Q2-. Senyawa yang terbentuk :
2X+ + Q2- ---------> X2Q, ikatan ionik
|
| 4. |
Unsur Y dengan nomor atom 13 dan nomor massa 27. Unsur tersebut terletak pada golongan dan periode….
A. II A dan 2
B. III A dan 2
C. III A dan 3
D. III B dan 3
E. III B dan 4
|
Unsur Y dengan konfigurasi (2,8,3) termasuk gol IIIA/3
|
| 5. | Berikut ini adalah data fisik dari 2 buah zat :
| Senyawa | Daya hantar listrik | Titik didih | Titik leleh |
| X | + | ˃ 500 0C | ˃ 4000C |
| Y | - | 80 0C | 50 0C |
Dari data tersebut, jenis ikatan yang terdapat dalam senyawa X dan Y berturut-turut adalah….
A. ion dan kovalen polar
B. kovalen non polar dan ion
C. kovalen dan hidrogen
D. ion dan kovalen koordinat
E. hidrogen dan kovalen non polar
Penjelasan :
Larutan X dapat menghantar arus listrik & t.d dan t.l tinggi, ciri khas ikatan ion; larutan Y tidak menghantar arus listrik tapi t.d dan t.l relatif tinggi, ciri ikatan kovalen polar. Jika ikatan kovalen non polar, maka t.d dan t.l sangat rendah.
|
| 6. |
Persamaan reaksi antara logam aluminium dan larutan asam sulfat sebagai berikut:
2Al (s) + 3H2SO4 (aq) ---> Al2(SO4)3(aq) + 3H2(g)
Jika gas hidrogen yang dihasilkan 6,72 liter pada STP, maka massa aluminium sulfat yang dihasilkan adalah ... (Ar O = 16, Al = 27, S = 32,)
A. 34,2 gram
B. 68,4 gram
C. 102,6 gram
D. 136,8 gram
E. 171,0 gram
|
mol gas H2
= 6,72/22,4 = 0,3
mol Al-sulfat
= (1/3)x0,3
= 0,1 mol
Massa Al-sulfat
= 0,1 x 342 g
= 34,2 g
|
| 7. |
Kalsium direaksikan dengan oksigen menghasilkan senyawa kalsium oksida. Menurut persamaan reaksi: 2 Ca (s) + O2 (g) 2 CaO (s)
Jika direaksikan 4 gram kalsium ( Ar Ca = 40) dan 4,48 liter gas oksigen pada STP, maka kalsium oksida yang terbentuk adalah....
A. 0,56 gram
B. 5,60 gram
C. 11,2 gram
D. 22,4 gram
E. 56,0 gram
|
mol Ca = 4/40 = 0,1; mol gas O2
= 4,48/22,4 = 0,2; pereaksi pembatas adalah Ca karena mol Ca/2 lebih kecil dari pada mol O2/1
sehingga mol CaO
= (2/2) x 0,1 = 0,1 mol
Massa CaO
= 0,1 x 56 g = 5,60 g
|
| 8. |
Diketahui persamaan reaksi:
P2O5 (s) + 3 H2O (l) ---------> 2 H3PO4 (aq)
Nama senyawa dari salah satu reaktan pada persamaan reaksi tersebut adalah …
A. Asam fosfat
B. Fosfor (II) oksida
C. Fosfor oksida
D. Fosfor penta oksida
E. Difosfor penta oksida
|
Penamaan oksida non logam harus disebut unsur yang lebih elektropositif dan diawali dengan awalan di, tri, tetra....
Untuk oksida logam tidak perlu diawali di,tri,..., untuk logam yang memiliki biloks lebih dari satu macam harus diikuti dengan nomor boloks dalam angka romawi.
|
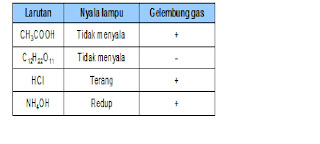
| 9. | Dari hasil uji elektrolit diperoleh data berikut:
Larutan-larutan yang bersifat elektrolit adalah…
A. CH3COOH, NH4OH dan HCl
B. NH4OH, CH3COOH, dan C12H22O11
C. C12H22O11, NH4OH, dan HCl
D. HCl, CH3COOH dan C12H22O11
E. CH3COOH, C12H22O11 dan NH4OH
|
Ciri elektrolit larutan kuat = ada gas banyak, nyala lamputerang;
Ciri larutan elektrolit lemah = nyala lampu redup, ada gas atau lampu mati tapi ada gas. Ciri larutan non elektrolit = lampu mati, tidak ada gas
|
| 10 |
Suatu asam berbasa satu memiliki tetapan kesetimbangan asam (Ka) = 10-7. Jika larutan asam ini mempunyai konsentrasi 0,1 M, maka pH larutan adalah ….
A. 1
B. 2
C. 3
D. 4
E. 5
|
[H+] = √Ka.M
= √(10-7.(0,1))
= 10-4
pH = -log 10-4 = 4
|
| 11. |
Sebanyak 50 ml larutan HA ( asam lemah ) dititrasi dengan larutan NaOH 0,1 M . Grafik yang menggambarkan titrasi tersebut adalah ….
|
HA adalah asam lemah, pH awal sebelum titrasi sekitar 3. Opsen D adalah jawaban terbaik.
|
| 12. |
Diketahui data hasil percobaan titrasi larutan NaOH dengan larutan HCl sebagai berikut :
Berdasarkan data tersebut konsentrasi NaOH adalah…
A. 0,098 M
B. 0,100 M
C. 0,101 M
D. 0,102 M
E. 0,104 M
|
M1 = (V2 x M2)/V1
= (20,2 x 0,1)/20
= 0,101 M
|
| 13. |
Larutan penyangga dapat dibuat dengan mencampurkan 100 mL larutan CH3COOH 0,1 M dengan larutan....
A. 80 mL natrium hidroksida 0,1 M
B. 100 mL natrium hidroksida 0,1 M
C. 120 mL natrium hidroksida 0,1 M
D. 50 mL asam klorida 0,1 M
E. 100 mL asam klorida 0,1 M
|
Campuran asam lemah dengan basa kuat atau basa lemah dengan asam kuat akan menghasilkan larutan penyangga jika yang tersisa adalah asam lemah atau basa lemah.
Jawab A : 8 mmol basa kuat + 10 mmol asam lemah -------> tersisa 2 mmol asam lemah dan terbentuk 8 mmol garam shg bersifat sbg larutan penyangga.
|
| 14. |
Campuran berikut yang mengalami hidrolisis parsial dan bersifat asam adalah ....
A. 50 mL NaOH 0,2 M + 50 mL HCl 0,2 M
B. 100 mL CH3COOH 0,2 M + 50 mL KOH 0,2 M
C. 50 mL NH3 0,2 M + 100 mL HCl 0,1 M
D. 100 mL NH4OH 0,2 M + 100 mL H2SO4 0,2 M
E. 20 mL KOH 0,2 M + 50 mL HCN 0,2 M
|
Campuran asam lemah dengan basa kuat atau basa lemah dengan asam kuat akan menghasilkan hidrolisis parsial jika semua pereaksi habis bereaksi membentuk garam, maka garam yang terbentuk adalah garam yang mengalami hidrolisis sebagian.
A.Tidak mengalami hidrolisis karena asam kuat + basa kuat
B.Terbentuk larutan penyangga karena tersisa asam lemah dan terbentuk garam
C. Jawaban terbaik
D.Tersisa asam kuat, sehingga bersifat asam kuat.
E. Tersisa asam lemah (merupakan larutan penyangga).
|
15. |
Kelarutan AgCl (Ksp = 1,8 × 10-10) dalam larutan HCl 0,01 M adalah .…
A. 1,8 × 10–8 M
B. 1,8 × 10–5 M
C. 1,8× 10–4 M
D. 1,6 × 10–3 M
E. 1,6 × 10–3 M
|
AgCl (s) <===> Ag+ + Cl-
HCl (aq) --------> H+ + Cl-
Ksp = [Ag+][Cl-]
(1,8 × 10-10) = [Ag+](0,01)
[Ag+]=(1,8 × 10-8)
|
16. |
Titik didih larutan yang dibuat dengan cara melarutkan 5,85 gram NaCl dalam 1 kg air adalah… (Kb air = 0,52, Ar Na = 23, Cl = 35,5)
A. 100,101°C
B. 100,103°C
C. 100,104°C
D. 100,105°C
E. 100,106°C
|
∆Tb = Kb.(1000/p).(g/Mr).i = (0,52)(1000/1000)(5,85/58,5)(2)
= 0,104ᵒC
Tb larutan
= 100 + 0,104
= 100,104ᵒC
|
| 17. |
Perhatikan diagram P-T berikut:
Berdasarkan diagram diatas, bagian yang menunjukkan kenaikan titik didih (∆Tb) adalah ….
A. A – H
B. B – C
C. D – E
D. G – H
E. I – J
|
HG daerah perubahan titik beku, H titik beku pelarut, G titik beku larutan
IJ daerah perubahan titik didih, I titik didih pelarut, J titik didih larutan
B titik tripel pelarut, E titik tripel larutan
|
| 18. |
Berikut ini beberapa contoh penerapan sifat koloid dalam kehidupan sehari-hari:
1. Pembentukan delta di muara sungai
2. Penambahan tawas pada pengolahan air minum
3. Penyaringan debu pabrik
4. Pemutihan gula tebu
5. Proses cuci darah
Sifat adsorbsi ditunjukkan oleh nomor ….
A. 1 dan 2
B. 2 dan 4
C. 3 dan 4
D. 1 dan 4
E. 5 dan 4
|
1. Pembentukan delta di muara sungai == koagulasi.
2. Penambahan tawas pada pengolahan air minum === adsorpsi dan koagulasi
3. Penyaringan debu pabrik === elektroferesis
4. Pemutihan gula tebu === adsorpsi
5. Proses cuci darah === dialisis
|
| 19. |
Diketahui senyawa karbon:
Pasangan yang merupakan isomer fungsi adalah ...
A. 1 dan 2
B. 2 dan 4
C. 2 dan 3
D. 1 dan 4
E. 3 dan 4
|
Isomer fungsi terjadi antara (1) alkohol dengan eter, (2) aldehid dan keton (3) asam alkanoat dan ester.
1. keton 2. Akohol 3. Asam alkanoat 4. Aldehid
Yang berisomer fungsi adalah (1) keton dengan (4) aldehid
|
| 20. |
Perhatikan reaksi berikut ini:
I. CH3-CH2-CH2-Cl + KOH → CH3-CH=CH2 + KCl + H2O
H2SO4 Pekat
II. H3CCH2COOH + CH3OH ------------->
CH3CH2COOCH3 + H2O
Jenis reaksi dari kedua persamaan reaksi diatas secara berturut-turut adalah ...
A. adisi dan substitusi
B. adisi dan eliminasi
C. substitusi dan eliminasi
D. eliminasi dan adisi
E. eliminasi dan substitusi
|
Reaksi adisi ditandai dengan perubahan ikatan rangkap menjadi ikatan tunggal.
Reaksi eliminasi ditandai dengan perubahan ikatan tunggal menjadi ikatan rangkap.
Reaksi substitusi ditandai dengan pertukaran gugus/atom tanpa ada perubahan jenis ikatan |
| Suatu senyawa karbon diuji dengan :
1) Larutan Fehling akan menghasilkan endapan merah bata
2) Larutan Tollens akan menghasilkan endapan cermin perak
3) Larutan kalium dikromat akan menghasilkan asam karboksilat
Senyawa karbon tersebut mengandung gugus
fungsi….
A. Keton
B. Aldehida
C. Alkohol
D. Ester
E. Eter
|
Gugus fungsi yang positif terhadap pereaksi Fehling,Tollens dan oksidator adalah aldehid Aldehid + Fehling ----------> endapan merah bata
R-CHO + Cu2+ ----------> R-COOH + Cu2O
· Aldehid + Tollens ------->endapan perak
R-CHO + Ag+ ----------> R-COOH + Ag
· Dioksidasi menjadi asam alkanoat
R-CHO + Cr2O72+----------> R-COOH
|
| 22. | Senyawa turunan benzena yang dapat digunakan
sebagai anti oksidan pada minyak nabati adalah ...
A. Fenol
B. Anilin
C. Natrium Benzoat
D. Trinitro Toluena
E. Butil Hidroksi Toluena
|
Fenol sbg bahan desinfektan,
Anilin sbg bahan pewarna diazo
Na-Benzoat sebagai pengawet makanan dan minuman
TNT sebagai bahan peledak
BHT dan BHA sebagai anti oksidan
|
| 23. |
Perhatikan tabel berikut:

Pasangan yang tepat dari ketiga komponen tersebut adalah,,
A. 1
B. 2
C. 3
D. 4
E.5
|
Urutan polimer, monomer, jenis polimerisasi yang benar :
Polietena--------etena-------adisi
Sellulosa------glukosa------kondensasi
PVC--------vinil klorida-----adisi
Karet alam (poliisoprena)----isoprena----adisi
Protein----asam amino-----kondensasi
Tips. : hasil polimerisasi adisi biasanya diawali dengan poli |
| 24. |
Data percobaan uji protein beberapa bahan makanan
sebagai berikut :
Protein yang mengandung inti benzena dan unsur
belerang adalah …
A. A dan B
B. A dan C
C. B dan D
D. C dan D
E. B dan E
|
Uji biuret untuk menguji adanya ikatan peptida, semua protein POSITIF
Uji xantoproteat untuk menguji adanya cicncin benzen pada asam-asam amino dalam protein. Hanya protein yang mengandung gugus samping fenil alanin, tirosin dan triptopan yang POSITIF terhadap uji ini.
Uji timbal(II)asetat untuk menguji adanya belerang (sulfida) dalam protein. Hanya asam-asam amino yang memiliki unsur S yg positif terhadap uji ini.
|
| 25. |
Diketahui beberapa karbohidrat sebagai berikut:
1) Glukosa
2) Maltosa
3) Fruktosa
4) Sukrosa
5) Selulosa
Pasangan karbohidrat yang termasuk disakarida
adalah ….
A. 1 dan 2
B. 1 dan 3
C. 2 dan 4
D. 3 dan 4
E. 4 dan 5
|
Kelompok monosakarida : glukosa, fruktosa, ribosa, galaktosa,...
Kelompok monosakarida : sukrosa, maltosa, laktosa
Kelompok polisakarida : amilum, sellulosa, glikogen, lignin
|
| 26 | Diketahui reaksi penguraian amonia :
2NH3(g) -----> N2(g) + 3H2(g) △H = +92,4 kJ
Diagram tingkat energi dari reaksi di atas adalah ….
|
Diagram energi digambar dengan meletakan pereaksi sebelum tanda panah dan produk setelah tanda panah. Panah mengarah ke atas untuk reaksi endoterm (∆H=positif), dan mengarah ke bawah untuk reaksi eksoterm (∆H=negatif).
Dalam hal di atas jawaban terbaik adalah (D).
|
| 27. |
Diketahui energi ikatan rata – rata sebagai berikut :
C = C
|
614 kJ/mol
|
C - H
|
413 kJ/mol
|
C - C
|
384 kJ/mol
|
O - H
|
463 kJ/mol
|
C - O
|
358 kJ/mol
|
|
|
Perubahan entalpi dari persamaan reaksi :
H2 C = CH2 + H-O-H ------> H3C - CH2-OH sebesar ….
A. – 78 kJ/mol
B. + 87 kJ/mol
C. + 97 kJ/mol
D. + 178 kJ/ mol
E. + 197 kJ/mol
|
∆H = jumlah energi pemutusan – jumlah energi pembentukan
= {E C=C + E O-H} – {E C-H + E C-C + E C-O}
= (614 + 463) – (413 + 384 + 358)
= 1077- 1155
= -78 kJ/mol
|
| 28. |
Berikut adalah tabel data laju reaksi :
2NO (g) + Br2 (g) -------> 2NOBr (g)

Reaksi antara NO dan Br2 memiliki rumus laju
reaksi….
A. V = k [NO][Br2]
- V = k [NO][Br2]2
- V = k [NO]2[Br2]
- V = k [NO]2[Br2]2
- V = k [NO]2
|
Orde reaksi terhadap NO lihat konsentrasi Br2 sama (no 1 dan 3)
Konsentrasi NO naik 2 kali semula, laju reaksi naik 4 kali, maka m = 2
Orde reaksi terhadap Br2 lihat konsentrasi NO yang sama (no 1 dan 2)
Konsentrasi Br2 naik 2 kali semula, laju reaksi naik 2 kali, maka n = 1
Persamaan laju : V = k [NO]2[Br2]
|
| 29. |
Diketahui data percobaan dari laju reaksi:
CaCO3(s) + 2HCl(aq) → CaCl2(aq) + CO2(g) + H2O(l)
Faktor yang mempengaruhi laju reaksi pada
percobaan nomor 2 dan 3 adalah....
A. suhu
B. konsentrasi
C. luas permukaan
D. jenis zat
E. katalis |
pada reaksi nomor 2 dan 3, kondisi suhu dan konsentrasi sama yaitu 25ᵒ dan 2 M. Yang membedakan adalah bentuk padatan CaCO3 yaitu kepingan dan serbuk maka faktor yang terukur adalah luas permukaan.
|
| 30. |
Diketahui reaksi kesetimbangan :
N2(g) + 3 H2(g) <===> 2NH3(g) △H = - 92 kJ
Jika suhu diturunkan, maka kesetimbangan bergeser ke ....
A. Kekanan, NH3 bertambah
B. Kekanan, NH3 berkurang
C. Kekanan, NH3tetap
D. Kekiri, NH3 bertambah
E. Kekiri, NH3 berkurang.
|
Kenaikan suhu menggeser kesetimbangan ke arah reaksi endoterm dan penurunan suhu akan menggeser ke arah reaksi eksoterm. Reaksi tersebut adalah eksoterm maka penurunan suhu akan menggeser ke arah kanan, jumlah N2 dan H2 berkurang dan NH3 bertambah.
|
| 31. |
Pada reaksi kesetimbangan :
2 SO3(g) <======> 2 SO2 (g) +O2(g)
Dalam volume 5 liter terdapat gas SO3 , SO2 dan O2 berturut-turut 0,4 mol; 0,4 mol dan 0,2 mol . Harga Kc pada kesetimbangan tersebut adalah ….
A. 0,02
B. 0,04
C. 0,08
D. 0,20
E. 0,50
|
Mol total = (0,4+0,4+0,2) = 1,0 mol
[SO3]= [SO2]=(0,4/5) = 0,8 M
[O2]=(0,2/5) = 0,04 M
Kc = [SO2]2 [O2]/ [SO3]2
= (0,8)2(0,04)/ (0,8)2
= 0,04
|
| 32. | Diketahui persamaan reaksi redoks
MnO4- (aq) + Fe2+(aq) + H2O(l) ---> MnO2(s) + Fe3+(aq) + OH-(aq)
Setelah disetarakan maka perbandingan koefisien
reaksi MnO4- : Fe 2+ adalah….
A. 1 : 3
B. 2 : 3
C. 1 : 5
D. 2 : 5
E. 5 : 2
|
Biloks Mn berubah dari +7 menjadi +4, menangkap 3e
Biloks Fe berubah dari +2 menjadi +3, melepas 1e
Agar jumlah elektron ditangkap = dilepas, maka ½ reaksi
MnO4- -----> MnO2 dikalikan 1
d Fe2+ -----> Fe3+ dikalikan 3,
shg MnO4- : Fe 2+ = 1 : 3
|
| 33. |
Perhatikan diagram sel berikut :
Diketahui Cu2+ | Cu Eo = + 0,34 V
Ni2+ | Ni Eo = – 0,25 V
Notasi sel tersebut adalah ... .
A. Cu | Cu2+ || Ni2+ | Ni
B. Ni | Ni2+ || Cu2+ | Cu
C. Cu | Ni2+ || Cu2+ | Ni
D. Ni | Cu2+ || Ni2+ | Cu
E. Ni2+ | Cu2+ || Ni | Cu
|
Yang memiliki Eᵒ lebih kecil harus teroksidasi, dan yang memiliki Eᵒ lebih besar harus tereduksi, maka dalam hal ini Ni teroksidasi dan Cu2+ tereduksi.
|
| 34. |
Diketahui :
Zn2+ + 2e → Zn Eo = – 0,76 Volt
Ag+ + e → Ag Eo = + 0,80 V0lt
Potensial sel standar (Eo sel) yang dihasilkan dari reaksi :
2Ag+(aq) + Zn(s) → 2 Ag(s) + Zn2+(aq)
adalah….
A. – 1,56 volt
B. – 0,04 volt
C. + 0,04 volt
D. + 1,56 volt
E. + 2,36 volt
|
E sel = E reduksi – E oksidasi
= 0,80 V – (-0,76 V)
= 1,56 V
|
| 35. | Perhatikan rangkaian elektrolisis berikut
Reaksi yang terjadi di anoda adalah ....
A. Cu 2+(aq) + 2e " Cu(s)
- Cu(s) " Cu2+(aq) + 2e
- H2O(l) + 2e " 2OH-(aq) + H2(g)
- H2O(l) " 2H+(aq) + O2(g) + 2e
E. 2H+(aq) + 2e " H2(g)
|
Pada sel tersebut, di katoda terjadi reaksi reduksi :
Cu 2+(aq) + 2e ----> Cu(s)
Sedangkan di anoda yang dioksidasi adalah air :
H2O(l) ----> 2H+(aq) + O2(g) + 2e
karena anion yang mengandung unsur O spt sulfat, nitrat, fosfat dll kalah bersaing dengan air di anoda.
|
| 36. |
Diketahui potensial elektroda standar :
Fe2+ l Fe Eo = - 0,44 V
Ni2+ l Ni Eo = - 0,25 V
Pb2+ l Pb Eo = - 0,13 V
Mg2+ l Mg Eo = - 2,37 V
Zn2+ l Zn Eo = - 0,76 V
Logam yang bisa digunakan untuk melindungi besi agar tidak mengalami korosi dengan sistem perlindungan katodik adalah ....
A. Ni dan Pb
B. Ni dan Mg
C. Pb dan Mg
D. Ni dan Zn
E. Mg dan Zn
|
Unsur yang dapat digunakan untuk perlindungan katodik adalah unsur yang memiliki potensial reduksi lebih kecil dibanding logam yang akan dilindungi agar logam yang dilindungi tidak teroksidasi. Dalam hal ini Eᵒ Fe adalah -0,44 V, maka yang dapat digunakan adalah Mg (-3,37 V) dan Zn (-0,76 V).
|
| 37. |
Pada elektrolisis larutan AgNO3 dihasilkan 5,4 gram logam Ag. Jika arus listrik yang sama dialirkan pada larutan CrCl3 , maka masa logam krom yang mengendap adalah .... (Ar Cr = 52; Ag = 108)
A. 0,87 g
B. 1,73 g
C. 2,56 g
D. 2,91 g
E. 3,60 g
|
Massa Cr (Ar Cr/PBO Cr)
------------- = -----------------------
Massa Ag (Ar Ag/PBO Ag)
Massa Cr (52/3
------------- = ------------
5,4 (108/1)
Massa Cr
= (5,4 x 52)/(3 x 108)
= 0,9 gram
|
| 38. |
Unsur X , Y dan Z terletak dalam satu perioda.
Unsur X berupa molekul sederhana
Unsur Y kristal logam
Unsur Z berupa molekul kovalen raksasa
Urutan ketiga unsur tersebut dari nomor atom terkecil adalah .....
A. X – Z - Y
B. X – Y - Z
C. Y – X - Z
D. Y – Z - X
E. Z – X - Y
|
1. unsur X, unsur sederhana harus berada di paling kanan, misal gol VIIA dan VIIIA
2. unsur Y, kristal logam harus berada di sebelah kiri, misal gol IA, IIA dan gol transisi.
3. unsur Z, molekul kovalen raksasa harus berada di antara X dan Y, yaitu unsur yang tidak
mudah terion, misal C dan Si.
|
| 39. | Berikut adalah beberapa contoh mineral :
1. Kalkopirit
2. Karnalit
3. Bauksit
4. Pirit
5. Pirolusit
Pasangan mineral yang keduanya mengandung unsur besi adalah….
A. 1 dan 2
B. 1 dan 4
C. 2 dan 3
D. 2 dan 5
E. 4 dan 5
|
1. kalkopirit, CuFeS2 sumber besi dan tembaga
2. karnalit, KCl.MgCl2.6H2O sumber magnesium dan kalium
3. bauksit, Al2O3.nH2O sumber alumunium.
4. pirit, FeS2 sumber besi
5. pirolusit, MnO2 sumber mangaan
|
| 40. |
Berikut adalah beberapa sifat unsur :
1. terdapat di alam sebagai molekul diatomik
2. sangat reaktif dan reduktor kuat
3. mempunyai keelektronigatifan besar
4. dapat membentuk basa kuat
5. mempunyai bilangan oksidasi positif
yang merupakan sifat unsur halogen adalah….
A. 1, 2, 3
B. 1, 3, 4
C. 2, 3, 4
D. 1, 3, 5
E. 3, 4, 5
|
1,3,5 adalah sifat-sifat unsur halogen.
2,4 adalah sifat-sifat unsur alkali
|